Chimie : un creuset d’innovations contre le cancer
Soutenues par la Ligue dans le cadre du programme «Équipes Labellisées», les recherches conduites par Raphaël Rodriguez et Sébastien Papot sont à l’intersection entre la chimie et de la biologie. Ces travaux permettent d’envisager des stratégies thérapeutiques inédites ciblant les cancers métastatiques, ou encore de concevoir des médicaments intelligents agissant sélectivement sur les tumeurs pour limiter la toxicité des traitements anticancéreux.
Septembre 2023 (n°399) – Texte : Jérôme Hinfray et Renaud Maridet – Illustrations scientifiques : Sophie Jacopin
Temps de lecture : 10 minutes
«… Les choses qu’on voit dans l’univers biologique sont les résultats du comportement de phénomènes physiques et chimiques…» On doit la citation à un des scientifiques et vulgarisateurs du XXe siècle, Richard Feynman(1). Cherchait-il par ces mots à répondre à la question posée par le non moins génial Erwin Schrödinger(2) en couverture d’un essai resté fameux : « Qu’est-ce que la vie ? ».
Une chose est sûre, dès qu’il s’agit d’avancées marquantes en matière de biologie et de médecine, leurs auteurs sont très souvent des chimistes ou des physiciens. La recherche sur le cancer n’échappe pas à la règle et, depuis la compréhension des mécanismes à l’origine de la maladie jusqu’à la conception et la synthèse de molécules thérapeutiques, les sciences physico-chimiques sont présentes et incontournables à toutes les étapes.
Les relations très étroites entre biologie et chimie font l’objet depuis quelques années d’un nouveau champ de recherche, la biologie chimique ou chemical biology, qui utilise des outils conçus par les sciences de la chimie pour aller sonder les cellules malades, comprendre leur fonctionnement, à l’échelle de la molécule, parfois de l’atome, et in fine développer des approches thérapeutiques ou diagnostiques inédites. Les travaux des équipes labellisées de Raphaël Rodriguez et Sébastien Papot constituent des illustrations concrètes de ce pan particulièrement innovant et prometteur de la recherche contre le cancer.
Les relations très étroites entre biologie et chimie font l’objet depuis quelques années d’un nouveau champ de recherche, la biologie chimique ou chemical biology… »
Fondamentales aujourd’hui, ces recherches soutenues par la Ligue pourraient être le creuset d’innovations thérapeutiques qui amélioreront demain la prise en charge des cancers. Les deux chercheurs nous expliquent comment est née leur motivation pour la recherche sur le cancer et ce que l’on peut attendre de leurs travaux.

Raphaël Rodriguez
Bio express :
2015 – Directeur de l’équipe Chemical Biology de l’Institut Curie
2017 – Directeur de Recherche au CNRS
2018 – Labellisation Ligue
2019 – Prix Tetrahedron Young Investigator Award
2022 – Chevalier de l’ordre national du Mérite, co-création de la société Adrestia Therapeutics
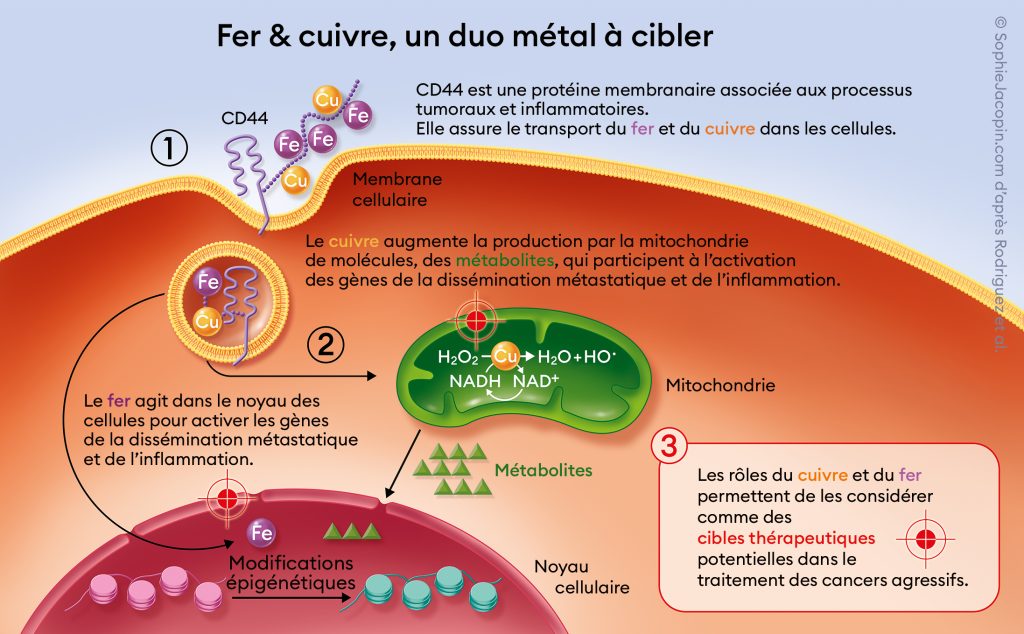
Raphaël Rodriguez est titulaire de la chaire Marie Curie de Chemical Biology à l’Institut Curie. Ses recherches lui ont déjà valu plusieurs prix scientifiques internationaux prestigieux et les derniers résultats que son équipe a publiés dans l’illustre revue Nature ont mis en évidence le rôle joué par le cuivre et le fer dans des processus communs au cancer et à l’inflammation.
Comment vous êtes-vous intéressé au cancer ?
Disons que le cancer se trouvait au bout d’un chemin qui a commencé dès le début de mes études de médecine, lorsque j’ai réalisé qu’un nombre non négligeable de médicaments avaient été inventés par des chimistes ou par des chercheurs qui s’intéressaient de près à la biologie cellulaire. Et justement, ce que je voulais, c’était combattre réellement les maladies et mettre au point des traitements efficaces. J’ai donc décidé d’étudier la chimie et la biologie. Cela m’a pris vingt ans pour maîtriser différents domaines de la réactivité en chimie de synthèse et en biologie cellulaire. Aujourd’hui, je ne suis pas spécialiste d’un domaine en particulier, mais je pense avoir une bonne vision d’ensemble, ce qui me semble être important pour comprendre le cancer, cette pathologie si complexe.
Quels sont les domaines que vous avez étudiés ?
En chimie, j’ai principalement étudié la synthèse de produits naturels complexes, la catalyse, et la chimie supramoléculaire, qui aide à comprendre comment produire des molécules biologiquement actives et comment les biomolécules et médicaments interagissent. En biologie cellulaire, je me suis intéressé à la biologie des membranes, au trafic cellulaire, au métabolisme et à la régulation épigénétique, la façon dont la biologie module l’identité même des cellules… L’idée est de comprendre dans le détail la physiologie d’une maladie pour pouvoir la soigner le plus efficacement possible. Il s’agit là d’un défi scientifique, surtout dans le domaine du cancer, une maladie particulièrement complexe. C’est pourquoi j’ai souhaité réunir une équipe multidisciplinaire regroupant des spécialistes de toutes les disciplines nécessaires pour appréhender la cellule cancéreuse dans toute sa complexité.
Comment vos travaux ont-ils commencé ?
Grâce à un article d’une équipe du Massachusetts Institute of Technology (MIT) publié en 2009 dans la revue Cell, qui montrait qu’il était possible de cibler les cellules cancéreuses à fort potentiel métastatique avec une petite molécule thérapeutique, sachant que ces cellules sont responsables de 90 % de la mortalité associée au cancer. Avec mon équipe, nous voulons donc comprendre les mécanismes moléculaires de la dissémination métastatique pour pouvoir la contrecarrer. Nous avons découvert qu’un métal, le fer, jouait un rôle fondamental dans la régulation de la transformation cancéreuse. De façon remarquable, la quantité de fer était plus importante dans les cellules métastatiques d’une même tumeur. L’étape suivante a été de comprendre comment ces cellules internalisaient le fer et quel était son rôle dans ce contexte. Nous avons notamment découvert qu’un autre métal, le cuivre, joue un rôle de catalyseur dans la programmation métabolique de la dissémination métastatique, d’où notre projet de cibler le cuivre mitochondrial dans ces cellules pour bloquer le processus métastatique (voir schéma ci-dessous).
Quelles perspectives vos travaux ouvrent-ils ?
Nous inventons des molécules qui interagissent avec les métaux dans la cellule et nous espérons en faire des médicaments. Nous pensons que les mécanismes que nous avons récemment mis à jour interviennent dans la majeure partie des tumeurs solides, ce qui nous amène à envisager des stratégies thérapeutiques fondées sur le ciblage des métaux, et peut-être de traiter des cancers métastatiques aujourd’hui incurables. Nous avons créé plusieurs start-up pour cela car la mise au point et le développement d’un médicament demandent d’autres expertises et infrastructures qu’on trouve difficilement dans le domaine académique. En effet, cela suppose de vraies prises de risque, notamment financières, et de décloisonner les disciplines pour avoir une vision d’ensemble.

Sébastien Papot
Bio express :
2014 – Professeur des universités, prix Pierre Fabre de l’innovation thérapeutique
2018 – Création Seekyo
2019-20 – Président de la Société de Chimie Thérapeutique
2022 – Labellisation Ligue
Sébastien Papot, professeur des universités, codirige l’équipe Synthèse organique au sein de l’Institut de chimie des milieux et des matériaux de Poitiers, une unité mixte de recherche du CNRS et de l’Université de Poitiers. Ses travaux visent la conception d’outils moléculaires ouvrant de nouvelles perspectives pour le traitement et le diagnostic du cancer.
Comment l’idée de travailler sur le cancer vous est-elle venue ?
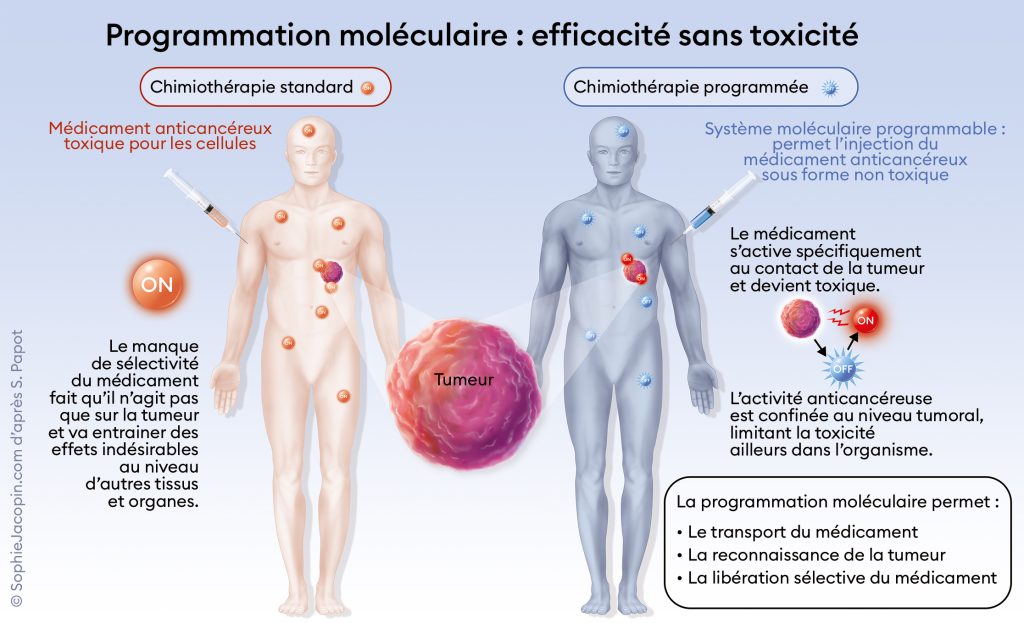
J’ai été particulièrement marqué par la leucémie dont mon filleul a été atteint ; cet événement a constitué pour moi une sorte de point de départ. Par la suite, j’ai effectué mes premières années de recherche dans un laboratoire où l’on travaillait sur le cancer, avec un projet de thèse sur un sujet passionnant : la vectorisation thérapeutique d’agents anticancéreux, c’est-à-dire l’utilisation d’un support pour acheminer le médicament directement sur la zone à traiter. C’est à ce moment-là que j’ai été frappé par le manque de sélectivité des traitements du cancer. Après ma thèse, j’ai travaillé à l’étranger dans d’autres domaines, mais, dès l’obtention d’un poste de chercheur en France, j’ai focalisé mes recherches sur le principe de programmation moléculaire. L’idée est d’élaborer des molécules qu’on peut aussi qualifier d’intelligentes, capables de transporter un médicament sous une forme inactive, non toxique, jusqu’à un endroit précis, le site de la tumeur, où il va être activé de façon très sélective. La délivrance du médicament est ainsi extrêmement précise, au contraire d’une chimiothérapie classique. Cela fait déjà vingt ans que je travaille sur ce sujet (voir schéma ci-dessous).
Quelles ont été les grandes étapes de vos travaux ?
Il a bien sûr fallu réunir une équipe pluridisciplinaire. Une fois notre concept élaboré, nous avons construit des molécules « programmables » et appris à en réaliser une synthèse chimique efficace. Ensuite, nous avons testé la capacité de ces molécules à distinguer les cellules tumorales des cellules saines. Les essais se sont succédé pour aboutir à des modèles plus évolués, des animaux greffés avec des cellules tumorales de patients. Enfin, nous avons créé une entreprise pour lever des fonds, afin de faire entrer ce concept dans une phase de développement préclinique et clinique. Ce qui fait qu’aujourd’hui, nous avons déjà une molécule en phase d’essais cliniques.
Qu’est-ce que la « volatolomique induite », que vous décrivez dans un article récent ?
C’est un concept que nous avons inventé avec la docteure Pauline Poinot, coresponsable de notre équipe labellisée par la Ligue, en parallèle de nos recherches sur la programmation moléculaire. Il s’agit en quelque sorte d’une « science des composés volatils émis par un organisme ». Nous le testons en tant que méthode diagnostique permettant de détecter précocement un cancer. Nous envoyons ainsi dans l’organisme d’un patient des molécules programmées qui agissent comme de véritables sondes, et libèrent des composés volatils au contact des tumeurs. Ces composés sont ensuite retrouvés dans l’air expulsé par le patient. Cet air est analysé au moyen d’un outil approprié pour établir un diagnostic. Nous sommes actuellement en train d’élaborer une typologie de réactions chimiques propres à chaque variété de tumeur, afin de pouvoir diagnostiquer tous les cancers.
Quels sont vos espoirs ?
Avec la volatolomique induite, nous espérons vraiment pouvoir développer un outil de diagnostic précoce des tumeurs. Notre succès dépendra beaucoup des fonds que nous parviendrons à lever. Nous aurions par exemple besoin d’un screening haut débit (technique d’identification de molécules) de l’ensemble des molécules contenues dans l’air expiré. Plus généralement, il nous faudrait un financement public plus important pour accélérer les phases de développement. Et dans un avenir proche, nos molécules programmées devraient permettre de développer de nouvelles thérapies pour améliorer le traitement des tumeurs solides. Bien sûr, une seule équipe et un concept, aussi pertinent soit-il, ne suffiront pas pour venir à bout du cancer. Il faut
associer toutes les forces à ce combat, et c’est pourquoi nous restons attentifs à toutes les nouvelles molécules élaborées par d’autres équipes à travers le monde. Mais je suis convaincu que notre démarche va ouvrir de nouvelles perspectives : après tout, la base de la vie, c’est bel et bien la chimie !